骨关节炎模型
365体育官方唯一入口在骨关节炎及相关关节损伤研究领域具有丰富经验,提供多种经过多方验证的关节腔注射/手术诱导骨关节炎及半月板损伤动物模型,我们可根据客户的需求为您选择合适的动物模型并参照GLP管理标准进行体内药效学评估。
骨关节炎介绍
骨关节炎(osteoarthritis,OA)是全球常见的慢性关节疾病,全球约有3亿OA患者。60岁以上老年人中,大约10%男性和18%女性患骨关节炎,其特征为关节软骨退行性变性及继发性骨质增生。OA患者出现骨关节炎疼痛、关节功能障碍,严重影响生活质量,是老年人致残的主要原因。骨关节炎的危险因素包括衰老、肥胖与代谢综合征、遗传和表观遗传因素、内分泌、关节形态和发育不良、膝盖受伤、长期劳损等。目前,主要利用非甾体抗炎药(NSAIDs)和关节内疗法(比如糖皮质激素和透明质酸)进行骨关节炎治疗,主要针对缓解疼痛和延缓疾病进展,如果治疗无效,关节最终只能被更换。近年来,以间充质干细胞为代表的细胞类药物在OA适应症方面展示了很好的应用前景。
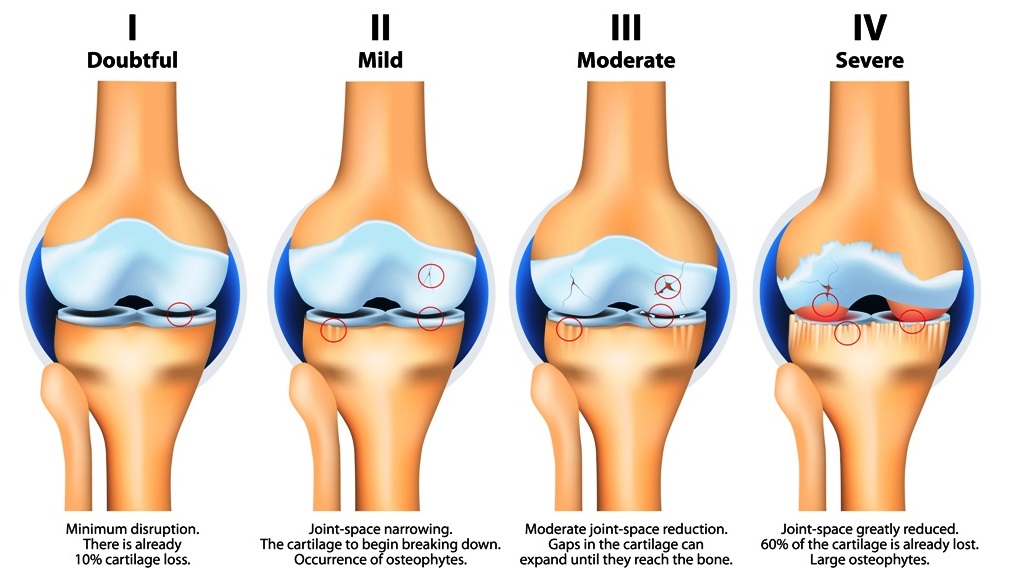
图1. 骨关节炎不同病理阶段(图片源自diseasefix.com)。骨关节炎表现为关节软骨流失,关节间隙边窄,骨赘形成等。
骨关节炎模型
人类的OA病理机制复杂, 尚没有一种动物能完全模拟人OA病变,OA动物模型的建立仍缺乏金标准。365体育官方唯一入口提供主要基于大鼠(MIA和MMT)以及兔(ACLT)的OA模型用于客户的药效评估,同时也可根据客户需要定制大动物OA模型(比如猪、非人灵长类、羊等)。
1 关节腔内注射法——碘乙酸钠模型
关节腔内注射碘乙酸钠(monosodium iodoacetate,MIA)或蛋白酶类物质是评估骨关节炎常用的模型之一,也被认为是研究骨关节炎治疗药物的良好模型之一。在小鼠/大鼠关节腔内注射碘乙酸钠可成功复制实验性骨关节炎。关节腔注射模型具有微创、成功率高、易操作、动物应激小等优点,但不能准确模拟人类骨关节炎的慢性变化。MIA模型也常应用于骨关节炎镇痛的药效评价之中。
动物种属:小鼠、大鼠、兔
2 关节手术诱导模型
手术模型具有造模时间短、成功率高、可重复性强等优点,能模拟大部分人膝关节不同时期的软骨变化,特别是软骨病变与在OA患者中观察到的相似。不同的动物种属采用不同的优势造模方法,我们常用的动物种属、相应的造模方法以及模型特征如下:
大鼠——内侧半月板撕裂(Medial meniscal tear,MMT)模型:MMT模型是通过切断膝关节内侧副韧带和内侧半月板诱导关节表面不稳定和关节不协调,进而导致快速进展的软骨退行性变化,该模型特点是软骨细胞和蛋白多糖(PG)丢失、纤维化、骨赘形成和软骨细胞克隆形成。MMT术后3周软骨即开始退化,在12个月内导致几乎所有大鼠胫骨内侧软骨完全丧失,同时该模型在早期出现软骨下骨吸收,而后期则表现出骨硬化特征。该造模方法易操作、创伤小、稳定性好、诱导关节软骨退化速度快,常用于评价软骨细胞保护药物、关节软骨修复以及骨保护疗法的药效评价。
兔——前十字韧带横断(Anterior cruciate ligament transection,ACLT)模型:兔类在关节软骨损伤后的修复与人软骨修复相似,很适合于观察药物对软骨修复的影响。在兔类中常用ACLT法诱导产生OA。ACLT法仅横断前交叉韧带, 较经典Hulth法简便易行且对动物的损伤较小, 其主要致病机理是破坏膝关节稳定性, 使其应力集中, 造成相应部位软骨损伤。兔ACLT术后4周左右开始出现软骨裂缝,而后软骨逐步遭到侵蚀至出现局灶性的软骨全层退化,除此之外,滑膜炎、关节囊纤维化、内侧副韧带及后交叉韧带肥大、半月板撕裂以及骨赘也是疾病进展。
检测指标
(1)疼痛检测:双足平衡测痛仪器、Von Frey filaments;
(2)血清/滑液炎症因子或者关节炎疾病进展及关节软骨分解代谢标记物;
(3)组织病理学:HE染色,番红-固绿染色,甲苯胺蓝染色;
(4)步态分析:主动步态、被动步态、运动功能;
(5)micro-CT:骨赘、软骨下骨骨密度及骨微结构变化。
案例展示
SD大鼠MMT骨关节炎模型
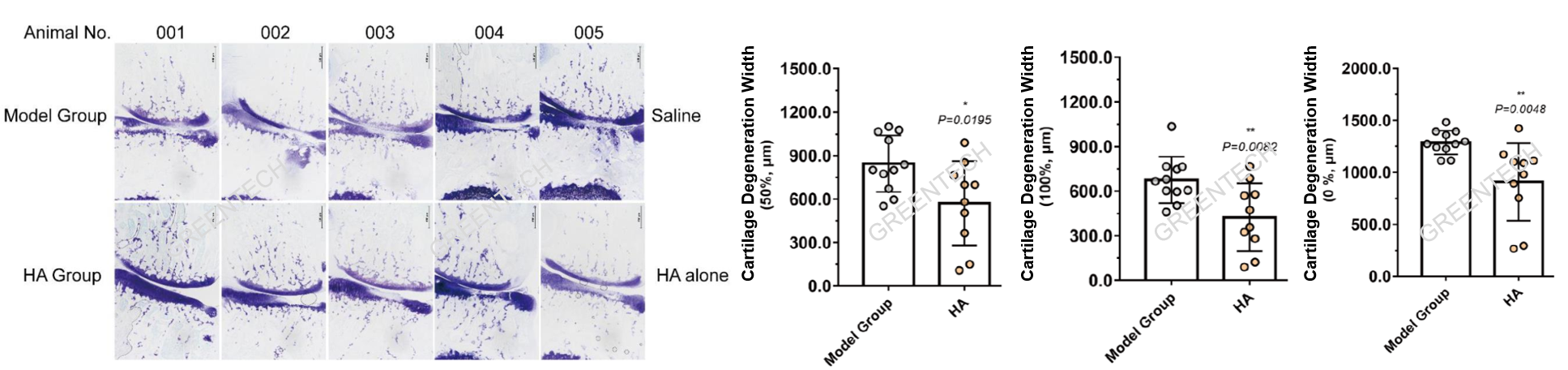
图2.关节甲苯胺蓝染色及软骨退化评分
半月板损伤模型
半月板损伤是常见的运动损伤之一,并导致膝关节功能障碍。修复半月板损伤对于缓解疼痛和预防退行性关节疾病(如骨关节炎)至关重要。起源于滑膜的毛细血管网为半月板提供直接的血液供应——但仅在半月板的某些“区域”中,对于半月板中完全无血管的 “白-白”区,这部分半月板损伤后其再生和愈合是非常困难的,因此针对半月板损伤修复的研究多集中在该区域。365体育官方唯一入口提供的基于兔类半月板撕裂的动物模型和相关病理、生物力学评价体系已得到了系统的验证,下图为半月板撕裂手术造模示意图。
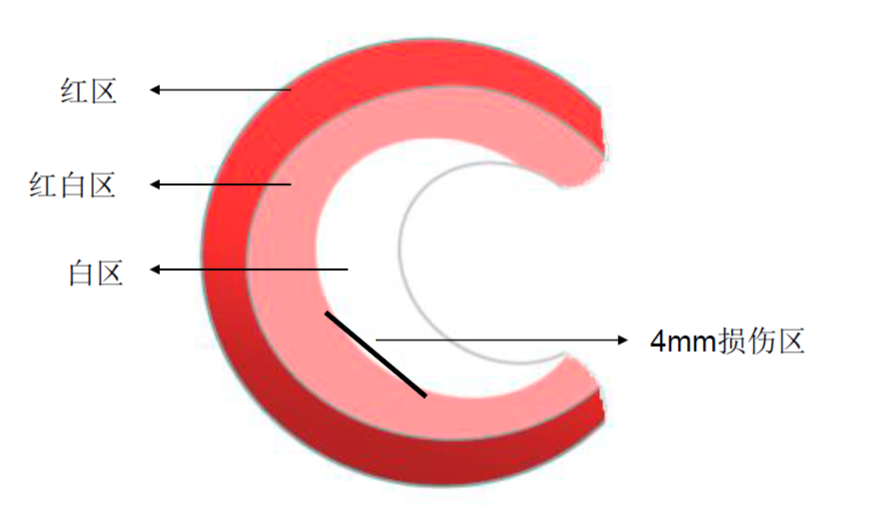
图3 兔半月板撕裂手术示意图
参考文献
1. P J Cope, K Ourradi, Y Li, M Sharif. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis Cartilage. 2019 Feb;27(2):230-239.
2. Abramoff B, Caldera FE. Osteoarthritis: Pathology, Diagnosis, and Treatment Options. Med Clin North Am. 2020 Mar;104(2):293-311.
3. erwin N, Bendele AM, Glasson S, Carlson CS. The OARSI histopathology initiative – recommendations for histological assessments of osteoarthritis in the rat. Osteoarthritis Cartilage. 2010 Oct;18 Suppl 3:S24-34.
4. S Laverty, C A Girard, J M Williams, E B Hunziker, K P H Pritzker. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the rabbit. Osteoarthritis Cartilage
. 2010 Oct;18 Suppl 3:S53-65.
5. John Twomey-Kozak, Chathuraka T Jayasuriya. Meniscus Repair and Regeneration: A Systematic Review from a Basic and Translational Science Perspective. Clin Sports Med. 2020 Jan;39(1):125-163.











